Selasa, 22 Desember 2020
Rabu, 11 November 2020
Resume 1 Taufiq Ramadhani Kusumah_G1C019016
Nama : Taufiq Ramadhani Kusumah
NPM : G1C019016
Tanda Tangan :
Kuliah No. # 07
Solidifikasi Logam Murni
Selama proses solidifikasi, itu akan melewati keadaan, ketika cairan dan padat akan hidup berdampingan, dan fase aturan menyatakan; mendefinisikan, berapa banyak fase atau apa variabel, yang dapat mengontrol ini. Kami juga akan memperkenalkan konsep energi bebas, entropi, dan energi permukaan. Mereka adalah konsep yang sangat penting untuk memahami proses solidifikasi. Kami juga akan menjelaskan: mengapa untuk solidifikasi untuk melanjutkan beberapa jumlah di bawah pendinginan diperlukan dan proses solidifikasi adalah proses tergantung waktu. Ada dua langkah dan ini disebut nukleasi: ketika sejumlah inti padat yang sangat kecil akan terbentuk dalam cairan.
Sekarang, mari kita lihat kurva pendinginan dari logam murni, bagaimana tampilannya. Katakanlah pada suhu tertentu di atasnya adalah titik leleh, itu cair. Struktur cairan sangat berbeda dari padat. Kami telah melihat bahwa padatan adalah kristal. Atom di padatan mereka diatur secara berkala. Padatan tidak dapat dikompresi modulus massalnya sangat tinggi. Dibandingkan dengan ini, cairan mengalir dengan mudah, sedangkan padat: tidak mengalir, kecuali Jika Anda menerapkan stres tertentu itu tidak mengalir, sedangkan cairan akan mengalir sendiri dan dapat mengambil bentuk wadah di mana Anda menyimpannya. Itu tidak begitu dalam kasus padat.
Dan ketika, cairan mendingin, plot suhu-waktu, itu bisa menjadi kurva halus seperti ini, dan ini terutama akan ditentukan oleh suhu logam dan sekitarnya. Dan biasanya ini mengikuti hukum pendinginan Newton. Dan itulah sebabnya saya telah meletakkannya seperti ini, dan ketika mencapai titik beku: itulah saatnya, jika beberapa bentuk padat maka dua fase akan hidup berdampingan untuk jangka waktu tertentu, cair dan padat. Dan selama proses solidifikasi, itu akan melepaskan panas juga dan Anda akan menemukan bahwa di sini, untuk beberapa waktu bahwa pendinginan hanya berhenti. Ini mempertahankan suhu konstan sampai proses solidifikasi selesai. Setelah ini selesai, maka sekali lagi, suhu terus menurun.
Sekarang, aturan fase Gibbs memberi kita hubungan sederhana antara jumlah fase yang dapat hidup berdampingan pada kondisi tertentu: kondisi eksperimental. Biasanya dengan kondisi eksperimental: maksud kami mengatakan suhu adalah satu dan mungkin tekanan di mana Anda melakukan percobaan. Biasanya untuk sebagian besar aplikasi praktis, tekanan ini akan menjadi satu atmosfer. Jadi, Anda memiliki dua variabel kontrol: suhu dan tekanan dan aturan fase Gibbs menyatakannya seperti ini: P + F = C + 2, di mana P adalah jumlah fase, C adalah jumlah komponen. Sekarang, dalam kasus logam murni komponen: itu hanya 1 logam, sehingga jumlah komponen adalah 1 dan F mewakili tingkat kebebasan. Pada dasarnya, ini adalah jumlah variabel kontrol yang Anda miliki. Pada dasarnya di sini, variabel kontrol adalah suhu dan tekanan.
 |
konsep gibbs energi bebas, jika kita menempatkan analogi, ini adalah semacam potensi. Katakanlah seperti energi, atau biarkan kami mengatakan listrik mengalir dari potensi yang lebih tinggi untuk menurunkan potensi. Demikian pula, transformasi apa pun ketika itu terjadi; itu akan terjadi ke arah: dari energi potensial yang lebih tinggi ke energi potensial yang lebih rendah. Dan Gibbs energi bebas Anda dapat mengatakan itu adalah analogi; itu adalah sesuatu yang mirip dengan potensi kimia. Dan kita tahu bahwa, dari hukum kedua termodinamika bahwa meskipun seluruh jumlah pekerjaan mekanis dapat dikonversi sepenuhnya menjadi panas, tetapi tidak mungkin untuk mengubah benar-benar panas menjadi pekerjaan mekanis.
Dan kami menggunakan ungkapan ini; setiap kali, ada reaksi yang terjadi pada atmosfer konstan dan untuk sebagian besar eksperimen atau proses praktis, tekanan atmosfer konstan. Dan biasanya itu adalah 1 tekanan atmosfer. Ada cara diferensial
Sekarang, mari kita lihat proses solidifikasi. Kami prihatin dengan stabilitas; stabilitas relatif dua fase: satu padat, satu lagi cair. Dan jika Anda mencoba untuk merencanakan, ini padat tidak entropi di sini: garis ini mewakili energi bebas sebagai fungsi suhu untuk padat dan garis ini mewakili energi bebas cairan sebagai fungsi suhu. Sekarang, mari kita lihat pada suhu tinggi: yang memiliki energi bebas lebih rendah? Ini cair. Jadi, pada suhu cairan yang lebih tinggi lebih stabil dan dua garis ini berpotongan di sini.
Dan ini ditunjukkan di sini. Kurva ideal yang awalnya kami tunjukkan. Tetapi di sini bahkan jika Anda meninggalkannya tanpa batas pada solidifikasi suhu ini tidak akan dimulai, kecuali Anda memiliki cukup energi untuk membuat permukaan baru; yaitu permukaan, yaitu: permukaan cairan padat dibuat. Jadi, ini ditunjukkan di sini. Dan setelah solidifikasi dimulai bahwa panas laten akan menaikkan suhu kembali ke titik beku atau suhu mencair. Dan di sini, cairan dan padat akan hidup berdampingan sampai seluruh jumlah cairan diubah menjadi padat dan setelahnya, itu akan mengikuti hukum pendinginan Newton normal.
diagram fase ini untuk logam murni atau bahan murni. Mari kita lihat kasus air saat membeku. Ada 3 fase yang melibatkan es, air, dan uap.
Dan ini ditunjukkan di sini, jika kita menyamakan, katakanlah jika kita kembali, jika kita menyamakan keduanya dan karena keduanya sama pada titik beku. Jadi, jika Anda dapat menyamakan dua dan sedikit
penyederhanaan aljabar, Anda akan dapat menunjukkan bahwa ini sama dengan; dP Sl s dan dT Vls
Anda dapat mengalikan pembilang dan penyebut dengan suhu beku,
titik dalam derajat Kelvin yaitu T: dP Tl s Sls . Dan ini adalah energi, yang enthalpy. dT T l s V l s
|
Dp |
H |
|||
|
(Yang itu) yakni hal-hal yang telah Anda dapat mengatakan, ini adalah panas laten transformasi: |
||||
|
Dt |
T V l s |
|||
Sekarang, dalam kasus ini reaksi air ke es, di sini ketika dari air Anda mendapatkan es Anda harus mengekstrak panas. (Demikianlah) sebelum apa yang telah itu berarti enthalpy negatif dan kita juga tahu bahwa ini, ketika bentuk es, ada ekspansi terkait, ekspansi volume. Jadi, V > 0. Oleh karena itu, ini positif, ini negatif, kemiringan ini negatif. Jadi, dalam kasus seperti itu, di mana pun ada perubahan volume terbalik (positif), maka kemiringan akan negatif.
Sekarang, mari kita lihat ini. Perluas konsep ini ke logam yang sangat umum digunakan yaitu besi; bahan logam yang umum digunakan pasti baja, yang merupakan paduan zat besi dan karbon. Dan mari kita lihat diagram fase besi murni. Sekarang besi murni dapat ada dalam keadaan padat, dapat memiliki struktur kristal yang berbeda. Misalnya, pada suhu rendah struktur kristalnya adalah kubik yang berpusat pada tubuh; sedangkan pada suhu menengah; itu struktur kristal adalah wajah berpusat kubik dan sebelum mencair lagi itu akan berubah menjadi struktur kubik terpusat tubuh. Oleh karena itu, dalam kasus khusus ini, kami berharap ada beberapa, tidak hanya 3 fase, beberapa fase dimungkinkan, setidaknya dua fase tambahan dimungkinkan.
Dan bagaimana garis keseimbangan ini akan diwakili dalam diagram fase, yang ditunjukkan di sini dalam hal ini. Aku baru saja membalikkannya, pada dasarnya, kau tetap bisa melakukannya. Saya menempatkan suhu di sini. Sebagai insinyur sangat sering, mudah untuk memvisualisasikannya seperti ini. Kami akan saat kami pergi ke bagian-bagian selanjutnya, kami melihat sistem multi komponen, kami akan selalu mewakili suhu di sepanjang sumbu y dan di sini, sumbu ini mewakili tekanan. Sekarang pada suhu yang lebih tinggi ini adalah wilayah, yang merupakan fase gas atau fase uap besi, dan tergantung pada suhu itu dapat ada seperti yang saya katakan pada suhu rendah, itu adalah bentuk bcc besi, dan umumnya dikenal sebagai besi alfa.
Dan dari sini mudah untuk menggambar kurva pendingin. Kurva pendinginan akan terlihat seperti ini. Anda akan memiliki, katakanlah, satu langkah di sini, ketika cairan berubah menjadi delta, sekali lagi akan ada, ini adalah transformasi solid-state, di sini dua fase pada suhu ini; delta dan gamma bisa hidup berdampingan. Kemudian lagi pada 910 gamma dan alpha, transformasi gamma ke alpha, FCC ke BCC transformasi sedang berlangsung, di sini juga, ini adalah suhu tetap di mana kedua fase ini dapat hidup berdampingan.
Sekarang, mari kita lihat konsep energi permukaan: apa yang disebutkan: bahwa untuk solidifikasi untuk melanjutkan beberapa jumlah under-cooling adalah suatu keharusan.
Dan ini adalah situasi, padat ini jenis nukleasi ini disebut nukleasi homogen, tidak ada substrat, itu terbentuk di dalam cairan dan misalkan memiliki radius 'r'. Kemudian area baru dibuat, area, luas permukaan sama dengan bola: 4 r 2 . Sekarang jika adalah energi permukaan per area unit, maka kita dapat mengatakan bahwa energi 4 r 2. Ini adalah energi yang perlu dipasok untuk membuat inti ini stabil. Dan ini akan datang dari transformasi energi bebas kimia itu energi bebas Gibb. Dan secara gambar itu ditunjukkan di sini. Katakanlah ini titik leleh: di sini pasti tidak ada nukleasi; tidak ada inti yang stabil, tetapi jika Anda di bawah dingin di sini, Anda memiliki kekuatan mengemudi. Ini adalah perbedaan dalam energi bebas.
Bagian ini proporsional dengan r3 dan bagian kedua adalah proposisi untuk r2 yang ditunjukkan di sini. Ini adalah energi permukaan: meningkat seperti ini, sedangkan, energi gratis ini per volume unit, itu menurun dan karena daya adalah kubus, itu menurun jauh lebih cepat. Jadi, ada kemungkinan total itu: jika Anda mengetahuinya, jika Anda menambahkan ini dan ini; ini akan menunjukkan perilaku seperti ini.
Dan apa yang kita katakan bahwa, jika punuk energi ini, ada energi puncak, jika ini dapat disilangkan maka apa yang terjadi bahwa jika radius inti meningkatkan energi akan terus menurun. Jadi, oleh karena itu, proses ini akan spontan. Jadi, agar inti itu stabil dan tumbuh secara spontan, punuk energi ini harus dilampaui dan ini dapat dengan mudah ditemukan dengan menemukan pada ukuran inti apa, perubahan energi gratis ini maksimal. Jadi, Anda membedakannya sehubungan dengan 'r' dan kemudian menyamakannya dengan 0. Dalam hal ini Anda mendapatkan kritis
|
ukuran inti menjadi |
2 |
dan Anda dapat mengganti ini kembali ke dalam ini, Anda mendapatkan apa yang |
|
fv |
||
Sekarang, juga dimungkinkan untuk memperluas konsep ini untuk mengetahui tingkat nukleasi dan bagaimana nukleasi homogen itu; di sini inti yang telah terbentuk, telah terbentuk dalam cairan tidak pada permukaan apa pun. Oleh karena itu, jenis nukleasi ini, kami mengatakan itu adalah nukleasi homogen. Tingkat nukleasi; itu mudah, maksudku, Anda dapat menggunakan ini, bahwa teori tingkat reaksi, tingkat di mana nukasi itu terjadi, ini adalah istilah frekuensi, yang kT, itu adalah energi Boltzmann Anda membagi oleh konstanta Plank. Ini adalah faktor frekuensi dan ini adalah faktor frekuensi total, tetapi frekuensi keberhasilan pembentukan jumlah inti, dari ini, ini adalah jumlah total upaya yang dilakukan.
Berapa banyak dari ini menjadi stabil yang akan tergantung pada apakah ini dapat melebihi atau mengatasi punuk energi. Ini diberikan oleh statistik Boltzmann, Anda melihat bahwa E adalah energi transformasi atas kT. Jadi, di sini energi transformasi ini; Anda kembali ke sebelumnya, apa yang Anda bisa? Lihat Anda dapat menggantikan ini di sana. Jadi, dalam ungkapan ini, semua ini dalam jumlah molar, jadi apa yang Anda lakukan, untuk mengetahui energi ini, Anda mengalikan pembilang dan penyebut dengan V2, yangmerupakan volume molar, dan kemudian Anda mendapatkan ini.
Sekarang terlepas dari itu, katakanlah, gambar ini menunjukkan beberapa inti terbentuk, tetapi ini adalah proses bersamaan; nukleasi dan pertumbuhan, keduanya berlangsung secara bersamaan, dan ini akan terus tumbuh.
Dan sekarang Anda dapat memperpanjang orientasi biji-bijian ini, jika Anda mencoba untuk mewakili pada proyeksi standar, apa yang akan terjadi? Katakanlah, mari kita coba untuk menempatkan orientasi kapak kubus dari masing-masing biji-bijian ini. Di mana mereka akan berada? Sekarang, jika itu adalah satu butir mengatakan, kita dapat mengatakan bahwa 1 sumbu kubus di sini, 001 di sini, 100 di sini, 001 di sini, tetapi Anda memiliki beberapa ini. Untuk yang kedua mungkin tidak berada di 3 titik ini, tetapi mungkin berada di suatu tempat; di sini, di sini, di sini
Sekarang, mari kita lihat nukleasi heterogen dan homogen, sekarang dalam kasus ini heterogen dan homogen, kita berbicara tentang nukleasi homogen ini. Dalam hal ini, bentuk inti berbentuk bulat, itu terjadi di dalam cairan, dan ada yang berbeda antarmuka antara padat dan cair, dan tidak ada substrat di sini. Misalkan kita menempatkan substrat kemudian tergantung pada sifat substrat jika bentuk padat, Anda akan memiliki interaksi energi permukaan. Jadi, energi permukaan; seperti yang kami katakan bahwa adalah energi permukaan antara cairan dan padat. Katakanlah, misalkan di sini, ini adalah padat dan sekitarnya adalah cairan. Jadi, ini dan ini mensubtends sudut sehubungan dengan substrat.
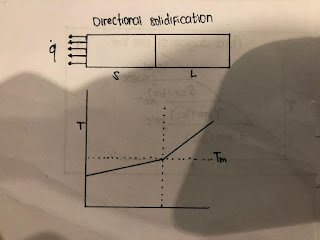
Sekarang, beberapa poin tentang arah; konsep solidifikasi arah, ketika Anda memungkinkan logam untuk memantapkan dalam wadah, jadi, pengaturan pendinginan eksternal akan menentukan bagaimana struktur atau evolusi struktur terjadi dalam padat ini. Dan ini secara skematis ditunjukkan di sini dalam diagram ini. Anda memiliki wadah. Mari kita katakan, kita bisa mengekstrak panas dari satu permukaan saja, jadi ini adalah padat; bagian dari padat, yang telah terbentuk. Ini adalah cairan, dan panas hanya dapat mengalir di sepanjang ini, dan seperti yang kita ketahui bahwa, ketika solidifikasi terjadi panas harus diekstraksi.
Sekarang dalam kasus khusus ini, sisi ini bahwa panas dapat mengalir, hanya jika ada gradien suhu yang menguntungkan. Seperti padat, di sini pada antarmuka cairan padat suhu adalah titik leleh, di sini adalah suhu. Di luar, Anda dapat mengontrol suhu, di sini, ini adalah pada Anda mengontrol, dan Anda dapat mengontrol tingkat ekstraksi panas. Jadi, gradien suhu ini akan menentukan tingkat ekstraksi panas. Oleh karena itu pergerakan antarmuka cairan padat akan tergantung pada seberapa cepat Anda bisa; bahwa panas dapat diekstraksi dan mengalir melalui lapisan padat yang tumbuh ini dan karena akhir dalam hal ini dalam cairan pada dasarnya adalah titik leleh, pada dasarnya cairan ini beberapa jumlah panas, ketika keluar, jika pergi ke sini, jadi, pada dasarnya apa yang akan Anda temukan bahwa suhu dalam cairan, itu naik.
Sekarang, mari kita lihat struktur logam ini dalam sedikit lebih detail. Mari kita lihat bahwa bagaimana biji-bijian, ketika Anda mengatur, dengan cara apa mereka berkemas, apa bentuknya dan apa peran energi permukaan.
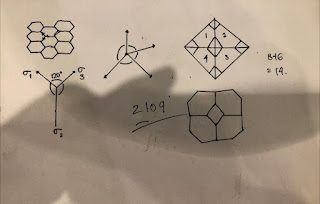
Sekarang, mari kita lihat struktur 2D, struktur biji-bijian dua dimensi, katakanlah misalkan kita menggambar seperti ini, segi enam. Katakanlah: "Benarlah (apa yang dengan membangun segi enam ini Anda dapat mengisi ruang ini. Sekarang titik adalah Anda dapat mengisi ruang ini dengan mengatur persegi juga: tetapi yang akan mewakili mikrostruktur yang tepat? Sekarang di sini, kita telah melihat batas ini memiliki beberapa energi yang terkait, masing-masing batas ini memiliki beberapa energi yang terkait, yang disebut ketegangan permukaan. Jadi, harus ada keseimbangan antara energi atau ketegangan permukaan yang ditunjukkan di sini.
Jadi, di permukaan atas 1, 2, 3, 4, jadi ini adalah empat permukaan, empat di bagian bawah, tetapi ini jika Anda mencoba untuk mengemas Anda tidak akan dapat mengisi ruang. Sekarang ada dua kriteria, satu adalah pengisian ruang dan kedua adalah keseimbangan energi permukaan atau keseimbangan ketegangan permukaan harus dipertahankan. Sekarang, ketika permukaan ini mereka bertemu. Akan ada batas biji-bijian dan sekarang dalam 3D mengatakan sangat mungkin bahwa banyak tempat, Anda akan memiliki satu ini, satu ini, satu ini, jadi akan ada empat baris seperti jika Anda mencoba untuk mengingat kembali bahwa struktur ikatan karbon dan empat ikatan. Jika semua energi ini hampir sama sudut harus sama dan saya pikir kami mengatakan bahwa sudut ini sekitar 109 ° atau lebih. Untuk mempertahankan, maksudku, keduanya; Harus menjadi bentuk biji-bijian; harus sedemikian rupa sehingga harus mengisi ruang, pada saat yang sama, di mana pun biji-bijian ini bertemu satu sama lain; akan ada garis-garis ini terbentuk, dan Anda akan memiliki ini; di mana pun keempat baris ini bertemu; mereka harus berada pada sudut di sekitar ini. Untuk memenuhi kondisi ini, telah ditemukan bahwa yang terdekat dapat dilakukan, adalah octahedron terpotong, jadi ini adalah octahedron: memotongnya seperti ini. Demikian pula, ini, Anda memotong maka Anda mendapatkan bentuk, katakanlah, sesuatu seperti ini, maksudku, mencoba untuk menunjukkannya di sini
Jadi, jenis oktahedron terpotong ini, jika Anda bungkus, yang hampir akan memenuhi kedua
kondisi ini; Artinya, ruang mengisi dan menyeimbangkan energi permukaan. (tidak ada audio
dari 48:01 hingga 48:07) dan akan menarik juga untuk melihat susu nan ini sedikit lebih cermat;
array 2D, jika Anda mencoba dan mengisi. Dan berikut adalah contoh yang ditunjukkan di sini,
saya mencoba meletakkan beberapa poligon yang saling bersentuhan, jadi ini adalah ruang yang
mengisi dua diagram D; ruang mengisi dua larik D. Sekarang, beberapa memiliki 5 sisi (tepi);
satu memiliki 6, 4 lainnya di sini. Sekarang, ketika Anda mengemasnya, Anda menghasilkan
sejumlah tepi, mereka bertemu satu sama lain. Ini disebut batas butir.
Mereka bertemu satu sama lain, katakanlah
ini akan memiliki satu susunan kristal. Katakanlah di
sini bidang bidang ini disusun seperti ini, katakanlah di sini mungkin bidang bidang itu disusun
dengan cara yang berbeda. Jadi, jika Anda berpindah dari satu butir ke butir lainnya; larik
periodik, And a tahu, struktur kristal masih sama, tetapi orientasinya berbeda, bidang yang sama
diorientasikan berbeda. Sekarang bisa dihitung ada 3, maksud saya, saat melakukan packing ini
juga menghasilkan selain edge, jumlah sudut, dimana 3 atau lebih dari 3 grain b ertemu seperti
disini, 3 grain bertemu. Demikian pula mungkin ada tempat, di sini, ada 1, 2, 3, 4 butir bertemu,
jadi Anda menghasilkan, pada gambar ini Anda memiliki sejumlah poligon yaitu P; Anda
memiliki kepastian
jumlah tepi E dan Anda juga memiliki ju
jumlah tepi E dan Anda juga memiliki jumlah sudut tertentu (C) dan ada hubungan.mlah sudut tertentu (C) dan ada hubungan.
Jika ini adalah pengisian spasi, ada hubungan seperti ini, yang terlihat seperti atau mirip dengan
Jika ini adalah pengisian spasi, ada hubungan seperti ini, yang terlihat seperti atau mirip dengan aturan fase Gibb yaitu P aturan fase Gibb yaitu P -- E + C = 1. Jadi, ini benar dalam kasus 2 dimensi, kasus 2D. Sekarang E + C = 1. Jadi, ini benar dalam kasus 2 dimensi, kasus 2D. Sekarang dalam kasus khususdalam kasus khusus ini Anda, coba hitung, sekarang Anda memiliki jumlah butir ini; ini adalah 1, ini Anda, coba hitung, sekarang Anda memiliki jumlah butir ini; ini adalah 1, 2, 3, 4, 5. Jadi jumlah poligon (P) adalah 5, jumlah sisi (E); Saya telah mencoba untuk menandai 2, 3, 4, 5. Jadi jumlah poligon (P) adalah 5, jumlah sisi (E); Saya telah mencoba untuk menandai di sini 1, 2, 3, 4, 5, 6. Jadi, Anda terus menandai, jadi jadilah; yang terakhirdi sini 1, 2, 3, 4, 5, 6. Jadi, Anda terus menandai, jadi jadilah; yang terakhir adalah 19, jadi ini 19. adalah 19, jadi ini 19. Jadi, jika Anda mengganti di sini, yang Anda dapatkan adalah: bahwa C = 15, itu berarti, Anda Jadi, jika Anda mengganti di sini, yang Anda dapatkan adalah: bahwa C = 15, itu berarti, Anda harus memiliki 15 sudut. Sekarang, Anda menghitung sudutnya; ini adalah 1, 2, 3, 4, 5, 6, 7, 8, 9, harus memiliki 15 sudut. Sekarang, Anda menghitung sudutnya; ini adalah 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15. Jadi, Anda men10, 11, 12, 13, 14, 15. Jadi, Anda mendapatkan 15 sudut itu, jadi ini terpenuhi dalam array 2D. dapatkan 15 sudut itu, jadi ini terpenuhi dalam array 2D. Dan aturan ini cukup umum.Dan aturan ini cukup umum.
Sebenarnya, ada hukum Euler, yang berlaku di permukaan polihedron, seperti misalnya
Sebenarnya, ada hukum Euler, yang berlaku di permukaan polihedron, seperti misalnya oktahedron terpotong, yang kita bicarakan. Oktahedron terpotong; juga, Anda dapat meneoktahedron terpotong, yang kita bicarakan. Oktahedron terpotong; juga, Anda dapat menerapkan rapkan hukum ini P hukum ini P -- E + C = 2, tetapi ini akan sama dengan 2, Di sini juga, dalam polihedron ini juga, E + C = 2, tetapi ini akan sama dengan 2, Di sini juga, dalam polihedron ini juga, Anda akan memiliki jumlah sisi, sudut, dan tepi. Jadi, oleh karena itu, ini bisa diterapkan. Ini Anda akan memiliki jumlah sisi, sudut, dan tepi. Jadi, oleh karena itu, ini bisa diterapkan. Ini adalah jenis hukum yang sangat umum; sangat umum, dapatadalah jenis hukum yang sangat umum; sangat umum, dapat diterapkan pada polihedron juga.diterapkan pada polihedron juga.
Sekarang, mari kita bicara lebih banyak tentang batas butir. Jadi, kami mengatakan bahwa ini
Sekarang, mari kita bicara lebih banyak tentang batas butir. Jadi, kami mengatakan bahwa ini satu butir, ini butir lainnya. Jadi, apakah susunan atom di sepanjang antarmuka ini yang disebut satu butir, ini butir lainnya. Jadi, apakah susunan atom di sepanjang antarmuka ini yang disebut batas butir. Jadi, ini adalah bbatas butir. Jadi, ini adalah batas dan saya katakan di sini struktur kristal ini dan ini mereka persis atas dan saya katakan di sini struktur kristal ini dan ini mereka persis sama.sama.
Jadi apa yang kamu lakukan? Katakanlah, misalkan, kita menghasilkan sebuah array; array atom,
Jadi apa yang kamu lakukan? Katakanlah, misalkan, kita menghasilkan sebuah array; array atom, bagaimana tampilannya? Anda dapat melakukannya sebagai latihan, di selembar kertasbagaimana tampilannya? Anda dapat melakukannya sebagai latihan, di selembar kertas, jika , jika Anda dapat mengambil selembar kertas transparan dan menggambar larik atom ini pada interval Anda dapat mengambil selembar kertas transparan dan menggambar larik atom ini pada interval teratur; mungkin; Anda mengambil bidang yang padat itu, Anda menggambar bidang yang padat teratur; mungkin; Anda mengambil bidang yang padat itu, Anda menggambar bidang yang padat ini seperti susunan atom satu lembar dan Anda ulangi. Anda mengambiini seperti susunan atom satu lembar dan Anda ulangi. Anda mengambil salinan Xerox itu di l salinan Xerox itu di lembar lain. Dan sekarang lembar transparan, Anda pakai itu dan coba putar. Putar melalui sudut lembar lain. Dan sekarang lembar transparan, Anda pakai itu dan coba putar. Putar melalui sudut tertentu dan itu artinya, apa yang Anda lakukan? Anda mencoba untuk memvisualisasikan, apa tertentu dan itu artinya, apa yang Anda lakukan? Anda mencoba untuk memvisualisasikan, apa sifat dari larik di dekat batas butir. Jadi, msifat dari larik di dekat batas butir. Jadi, mungkin menjadi bagian darinya, Anda mengatakan ini; ungkin menjadi bagian darinya, Anda mengatakan ini; itu artinya, kamu bisa. Dapatkah Anda menghasilkan susunan atom ini dengan memutar butir itu artinya, kamu bisa. Dapatkah Anda menghasilkan susunan atom ini dengan memutar butir ini? Jadi, pengaturan planar semacam ini, yang ditunjukkan di sini.ini? Jadi, pengaturan planar semacam ini, yang ditunjukkan di sini.
(Lihat Waktu Slide: 53:42)
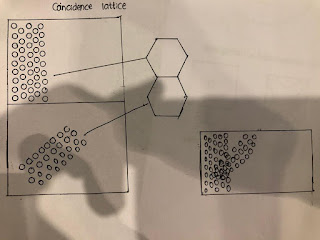
Ini disebut kebetulan situs kisi konsep, saya telah menggambar hal yang sama. Ini adalah salah satu biji-bijian di mana atom-atom ini diatur seperti ini, sedangkan dalam biji-bijian ini, atom diatur dalam mode ini, bidang yang sama, tetapi berbeda, itu diputar. Sekarang, apa yang terjadi di batas biji-bijian? Dekat batas biji-bijian beberapa lapisan 2 atau 3 lapisan apa yang terjadi? Ini adalah lapisan, ini adalah satu biji-bijian; Ini adalah biji-bijian lain, dan Anda dapat mengatakan ini adalah batas biji-bijian. Jika Anda memperpanjang kisi, Anda akan menemukan bahwa beberapa poin ini, mereka bertepatan dengan titik-titik kisi ini, yang ditandai di sini.
Jadi, ini adalah konsep, yang mewakili jenis batas biji-bijian. Sifat batas biji-bijian, orang mencoba untuk melihat pada tingkat rotasi dan jenis hubungan kisi kebetulan. Jadi, ini, maksudku, bukan berarti atom-atom ini menempati tempat-tempat ini. Anda hanya ditumpangkan dan melihat apa yang kebetulan kisi situs? Dan apa yang anda bisa? Cari tahu jarak kisi yang kebetulan ini. Ini jauh lebih besar dari jarak atom ini. Seperti, dalam kasus khusus ini, Anda melihat bahwa di sini, ini adalah satu jarak atom, jadi di sini, itu mencakup jarak, jarak ini adalah 1, 2, 3.
Begitu; Artinya, dimensi kisi bertepatan ini adalah 3 kali dimensi kisi utama, dan dengan ini dimungkinkan untuk menghubungkan dan mengetahui energi permukaan atau energi batas butir. Dan energi ini memiliki hubungan antara rotasi sudut antara butir butir yang bersebelahan dan begitulah cara energi batas butir diklasifikasikan dan s elanjutnya saat kita turun, Anda akan menemukan bahwa, ini adalah cara yang sangat mudah untuk mengklasifikasikan batas butir. Dengan ini kami menyimpulkan kuliah hari ini dan sebenarnya, kami telah membahasnya.